PCR 聚合酶
PCR 優化的一般指導原則
概述
NEB 針對基于 PCR 的應用提供多種 DNA 聚合酶。在產品的說明書或產品的網頁介紹上可以找到針對不同產品的特定優化建議。下面的一般指導原則將幫助您的
PCR 實驗順利進行。
反應建立指南
DNA 模板
? 盡可能使用高質量、經過純化的
DNA 模板。擴增未純化的DNA 時(菌落 PCR 或直接
PCR),請參閱特定 的產品信息
? 對于低復雜度的模板(如質粒、λ或BACDNA),每
50 μl 反應體系加入 1 pg-10
ng DNA
? 對于高復雜度的模板(如基因組DNA),每 50 μl 反應體系加入
1 ng-1 μg DNA
? DNA 濃度增高會降低擴增特異性,尤其是循環次數較多時
引物
? 一般長度為 20-40 個核苷酸
? 理想的 GC 含量為 40-60%
? 引物的 Tm 值可通過 NEB 的
Tm Calculator 計算 (www.neb.com/TmCalculator)
? 退火溫度應根據特定酶的推薦溫度設定。請注意
Q5? 和 Phusion?*
推薦的退火溫度是特別的
? 兩條引物間 Tm 差值應在 5℃ 以內
? 避免引物形成引物內二級結構(如發卡結構)以及引物二聚體
? 每條引物的終濃度應為 0.05-1 μM。請參閱特定酶的詳細推薦信息
? 引物濃度過高可能導致非特異性引物結合,并產生非特異性擴增產物
? 當擴增產物的大小超過 20 kb 時,引物長度應≥ 24 個核苷酸,GC 含量應在
50% 以上,Tm 值應在 60℃ 以上
? 當引入限制性位點時,需要在識別位點
5′ 端額外添加 6 個堿基
? 為了消除引物降解以及后續的非特異擴增,可使用熱啟動聚合酶(如
One Taq? 熱啟動 DNA聚合酶或
Q5 熱啟動超保真 DNA 聚合酶)
鎂離子濃度
? 對于大多數 PCR 聚合酶,Mg2+ 最佳濃度通常為 1.5-2.0 mM
? NEB 提供的大多數 PCR 緩沖液在 1 倍濃度下已含有足夠濃度的
Mg2+關于 Mg2+ 請參閱特定酶的產品信息
? NEB 提供多種不含 Mg2+ 的緩沖液,在需要嚴格控制
Mg2+ 濃度的實驗中,可向其中補加 Mg2+
? 如果需要,可通過將 Mg2+ 濃度增加 0.2–1 mM來進一步優化。在某些特定試驗中,聚合酶可能需要高達6mM 的鎂離子
? Mg2+ 濃度過高可能導致出現非預期
PCR 產物
? Mg2+ 濃度過低可能導致反應失敗
dNTPs
? 理想的 dNTP 濃度通常為每種 200 μM,但是某些聚合酶可能需要每種 dNTP 的濃度高達 400 μM。請參閱特定產品的說明書獲取詳細的推薦信息
? 過量的 dNTP 會螯合 Mg2+ 并抑制聚合酶的活性
? dNTP 濃度過低可增加保真性,但會減少產量
? 當使用古生菌 PCR 聚合酶時,引物、模板或dNTP 混合液中的尿嘧啶會導致反應失敗。針對這類反應可使OneTaq 或 Taq DNA 聚合酶聚合酶濃度
? 反應中的最佳聚合酶濃度因酶而異。請參閱特定產品的說明書獲取詳細的推薦信息
? 一般而言,過量的聚合酶會導致擴增失敗,特別是擴增長片段時
建立反應
? 除非使用熱啟動聚合酶(如 OneTaq 熱啟動DNA
聚合酶或 Q5 熱啟動超保真 DNA 聚合酶)否則需在冰上混合各種反應組份
? 盡可能最后加入聚合酶
? 建立好反應體系后立即放入已經預熱至變性溫度的熱循環儀中。請注意在使用熱啟動聚合酶(如
OneTaq 熱啟動 DNA 聚合酶或Q5
熱啟動超保真 DNA 聚合酶)時無需預熱熱循環儀
循環條件指南
變性
? 最佳的變性溫度范圍為 94℃-98℃,并因酶而異。請參閱特定產品的說明書獲取詳細的推薦信息
? 避免長時間或高溫度溫育(除非模板富含
GC)
? 通常,熱循環過程中變性時間為
5-30 秒
? NEB 提供基于核酸適配子的熱啟動聚合酶,無需額外變性步驟以激活聚合酶
退火
? 引物的 Tm 值可通過 NEB 的
Tm Calculator 計算 (www.neb.com/TmCalculator)
? 除 Q5 超保真 DNA 聚合酶或
Phusion 超保真DNA 聚合酶*以外,退火溫度一般設定為比引物對的最低
Tm 值低 2℃-5℃
? 使用 Q5 超保真 DNA 聚合酶或
Phusion 超保真 DNA 聚合酶*時,退火溫度一般設定為比引物對的最低
Tm 值高 0℃-3℃。請參閱特定產品的參考文獻獲取詳細的推薦信息
? 通過優化退火溫度或改用熱啟動
DNA 聚合酶(如 OneTaq 熱啟動
DNA 聚合酶或 Q5 熱啟動超保真 DNA 聚合酶)可避免形成非特異產物
? 通過溫度梯度 PCR 可優化退火溫度,將起始溫度設定為比引物對的最低 Tm 值低 5℃
? 理想狀態下,引物 Tm 值應比延伸溫度低。但是,如果計算出的 Tm 值比延伸溫度高,可采用兩步法 PCR(將退火和延伸合并為一步)
延伸
? 推薦的延伸反應溫度范圍為65℃-72℃,因酶而異。請參閱特定產品的說明書獲取詳細的推薦信息
? 延伸速率因酶而異。一般而言,延伸速率范圍為15-60
s/kb。請參閱特定產品的說明書獲取詳細的推薦信息
? 過長的延伸時間會增加錯配率,增加非特異擴增和/或減少擴增產量
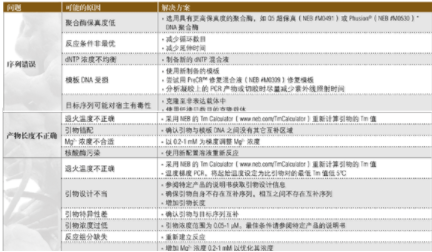
PCR 問題解決指南
下面的指南可用于解決 PCR 反應中出現的問題。關于優化反應的更多建議可訪問 NEB 網站的技術參考部分。
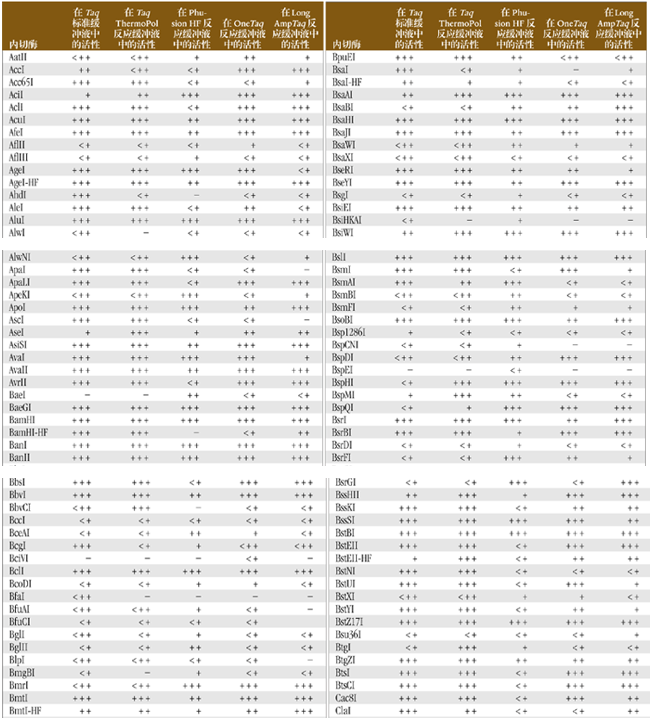
內切酶在 PCR 混合物中的活性
通常,PCR 反應后還要對產物進行酶切才能進行下一步工作。為了方便起見,可以將內切酶直接加到 PCR 反應產物中,而省略純化 PCR 產物的步驟。下表歸納了在 Taq、Phusion*、OneTaq 和 LongAmpTaq PCR 產物混合物中各種限制性內切酶的酶切活性。50 μl 反應體系中,將 5 單位內切酶加入到 PCR 反應產物中,在適當的溫度下反應 1 小時,凝膠電泳分析酶活性。PCR 反應產物中包括:1X ThermoPol 反應緩沖液、標準 Taq 反應緩沖液、Phusion HF 反應緩沖液、OneTaq 標準反應緩沖液或 LongAmpTaq 反應緩沖液,含 dNTPs(終濃度為 200 μM)、1 μg DNA 和 1 單位 Taq DNA 聚合酶。
注意:聚合酶在切割 DNA 后仍然有活性,并能改變切割的 DNA 片段末端,對后續的連接反應造成影響。含有限制性內切酶識別位點的引物在酶消化過程中有競爭抑制作用。在非最佳條件下進行酶切反應容易出現星號活性。如果遇到上述任何問題,則需用乙醇沉淀,酚/氯仿抽提或離心柱純化 DNA。
圖例
使用 5 單位內切酶切割 PCR 混合物:
+++ 表示完全切割
++ 表示 ~ 50% 被切割
+ 表示 ~ 25% 被切割 -
表示未被切割
北京百靈克生物科技有限責任公司
公司地址:北京海淀區永定路88號長銀大廈9C05
咨詢熱線:010-58895880/58896088
助力科研 托舉未來
- 上一篇:蛋白表達 2020/3/23
- 下一篇:復旦交大牽頭開發新冠病毒mRNA疫苗取得實質性進展! 2020/3/20
